
В реальной жизни вам вряд ли пригодится решение задач по химии «методом креста», например. Это больше подходит тем, кто претендует на участие в олимпиадах или занятия научной деятельностью. Но такие люди и без нас знают, как правильно решать задачи по химии по теме растворы.
Если же вам просто нужно сдать какой-то экзамен и забыть про этот совершенно непонятный и крайне сложный предмет раз и навсегда, мы предлагаем вам полезную информацию, которая поможет освоить хотя бы базовое решение задач на смешивание растворов по химии.
Правило смешивания или «Конверт Пирсона»
Довольно часто учащиеся сталкиваются с задачами по приготовлению растворов с определенной массовой долей вещества, растворенного в этом растворе, или же на смешение растворов различной концентрации. И диагональная модель «конверта Пирсона» в этом случае станет идеальным методом решения задач на концентрацию растворов по химии.
На заметку!
Конверт Пирсона имеет другое более распространенное название – правило креста.

Итак, возьмем в качестве примера задачу на растворы по химии с решением.
Допустим, необходимо сделать раствор с определенной концентрацией. При этом у нас в распоряжении 2 раствора с разной степенью концентрацией, нам не подходящей (то есть у одного концентрация выше, у второго – ниже).
Массу первого раствора обозначим m1, а второго - m2. При смешивании обоих растворов их общая масса будет рассчитываться путем суммы обеих масс.

В этом примере очевидно, что отношение массы первого раствора к массе второго – это и будет отношение разности массовых долей растворенного в них вещества и во втором растворе к разности соответствующих величин в первом растворе и в смеси в целом.
Есть и другое название у этой формулы – диагональная схема правила смешения.
Делается это так: одна массовая доля пишется над другой. Правее между ними записывается массовая доля вещества в растворе, который необходимо приготовить по условию. Затем идет процесс вычитания по диагонали – из большего значения вычитывается меньшее. Итог вычитаний покажет массовую долю для обоих растворов, которые нужны для приготовления раствора концентрации, нам необходимой.
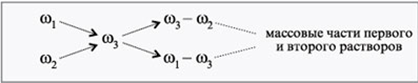
И если применить это диагональное правило (или правило креста) на практике, давайте приведем вам такой пример:
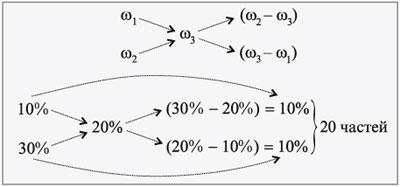
Пожалуй, на этом закончим рассматривать самые основные способы решения задач по химии на растворы. Если хорошенько вдуматься, то ничего сложного в этом нет. Если это все же вызывает у вас недоумение, не расстраивайтесь – наши авторы готовы в любое время дня и ночи не только решить для вас задачи по химии любой сложности, но и при необходимости сдать экзамен по этому невероятно сложному предмету! Например, заказать речь на защиту диплома вы можете по ссылке. Вам останется только наслаждаться жизнью!










